血小板是一种来源于巨核细胞的无核细胞(直径约2-4 um),在人体血液循环中存活7-10天,随后血小板在脾脏与肝脏被清除。血小板参与了人体多种生理与病理过程,包括血栓与止血,炎症,免疫,血管生成和肿瘤形成。
在临床上,患者被诊断为恶性血液病、再生障碍性贫血、特发性血小板减少性紫癜、血小板功能障碍及大剂量放化疗后均可引起血小板计数减少,血小板减少后导致患者出血风险大,而血小板输注是严重血小板减少症患者最快、最有效的治疗方法之一。
由于供者捐献的血小板保存期短且在其保存的条件下易导致细菌污染,因此导致临床血小板供应短缺,同时由于部分国家老龄化程度日益严重,也会导致适龄献血人群减少,从而加剧血小板供应短缺。
2018年7月12日《cell》在线刊登京都大学iPS细胞研究所(CiRA)教授Koji Eto课题组的研究成果“Turbulence Activates Platelet Biogenesis to Enable Clinical Scale Ex Vivo Production”对于人造血小板的研究具有重要意义。
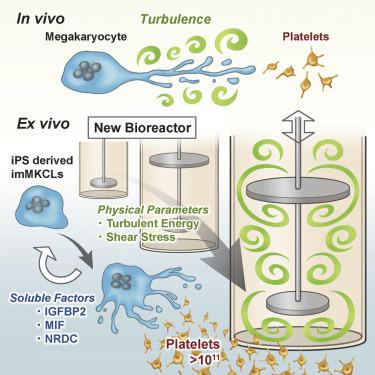
Koji Eto团队利用iPS细胞技术生产血小板以期望取代对捐赠者的依赖。血流在不断冲击巨核细胞时,掉落下来的细胞表面就是血小板。由于巨核细胞难从供者体内获得,因此充分利用诱导多能干细胞(Induced pluripotent stem cell,iPSC) 分化得到巨核细胞(生产血小板的母细胞)。为满足临床治疗需要,献血者血小板单采计数应≥ 2.5*1011 ,由于所需血小板数目大,即使能从iPSC分化得到巨核细胞,但是没有生物反应器,也很难达此产量,因此研究生物反应器是解决“人造血小板”的关键。为了研究产生血小板的理想物理条件,在一项新的研究中,Eto和他的团队接下来对小鼠骨髓---产生血液组分的组织---进行了实时成像研究。这些实验表明巨核细胞仅当暴露于湍流血流时才会产生血小板。湍流作用于巨核细胞时,产生胰岛素因子结合蛋白2(IGFBP)、巨噬细胞迁移抑制因子(MIF)和苯乙肼裂解酶(NRDC)等可溶性因子,这些因子促进体外培养中血小板的脱落,从而大大提高了体外血小板制备的数量。最终将“人造血小板”应用于动物体(小鼠与家兔)进行功能验证实验,血小板都相当程度地促进血液凝固和降低出血时间。
血小板来源于巨核细胞,而巨核细胞是从骨髓中的造血干细胞分化发展来的。造血干细胞首先分化生成巨核系祖细胞,也称巨核系集落形成单位(colonyformingunit-megakaryocyte,CFU-Meg)。祖细胞阶段的细胞核内的染色体一般是2-3倍体。当祖细胞是2倍体或4倍体时,细胞具有增殖能力,因此这是巨核细胞系增加细胞数量的阶段。当巨核系祖细胞进一步分化为8-32倍体的巨核细胞时,胞质开始分化,内膜系统逐渐完备。最后有一种膜性物质把巨核细胞的胞质分隔成许多小区。当每个小区被完全隔开时即成为血小板,一个个血小板通过静脉窦窦壁内皮间的空隙从巨核细胞脱落,进入血流。
体外诱导造血干细胞生成血小板作为传统的诱导方法虽然研究起步的时间较早,研究的也较为透彻,但仍受到诸如造血干细胞本身分化阶段较成熟,不能无限增殖,体外扩增效率不高和产生巨核细胞及血小板数量少等方面因素的限制。
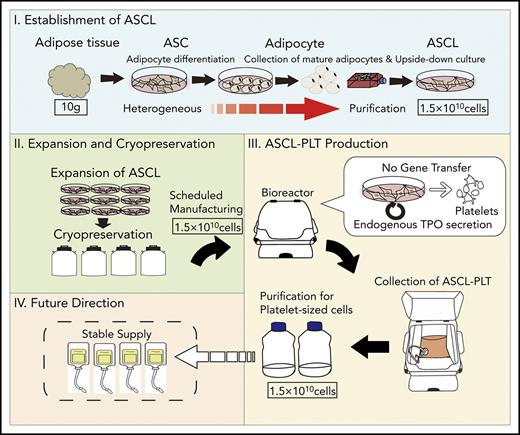
此外,近期研究表明间充质干细胞可能也是人造血小板的一个有效来源。Yumiko Matsubara带领的研究团队开发了一种血小板制造系统,该系统可来自于不依赖供者的细胞来源——人脂肪间充质干细胞系(adipose-derived mesenchymalstromal/stem cell line,ASCL)。该研究采用倒置培养瓶法获得ASCL,且获得的ASCL满足国际细胞治疗学会所定义的间充质干细胞(MSCs)的最低标准。研究发现,ASCL表现出至少2个月的增殖能力,无任何异常核型。ASCL来源的巨核细胞(megakaryocyte,ASCL-MK)在培养第8天达到高峰。ASCL来源血小板(ASCL-PLT)在培养第12天达到峰值。ASCL-PLT除了具有其他血小板所具有的特征之外,可能还额外具有MSC的功能。无论是建立ASCL还是诱导分化ASCL-PLT均不需要基因转导,仅采用内源性血栓生成素即可诱导分化。该诱导方案简单易行,不需要饲养层细胞,有利于推广该方案的临床应用。
用干细胞体外诱导生成大量的有功能的血小板的方法来替代目前临床上依靠无偿献血获得血小板的方法,不仅能够满足临床的需求,而且可以避免常规血小板制剂的某些缺点,提高输血的安全性。随着血小板相关研究的更加深入,人们发现血小板除了有止血和形成血小板血栓的作用外,还可以参与炎症及免疫应答反应,促进伤日愈合及血管生成,具有抗菌活性,并且可能与恶性肿瘤的发生有关。同时体外诱导生成血小板的研究极大地丰富了干细胞及干细胞替代治疗的相关认识。虽然以现有的技术水平要实现将体外诱导生成的血小板应用于临床还有一定的难度,但这无疑为解决临床血小板输注所面临的问题提供了一个很好的方法,其所带来的社会效益和经济效益都是巨大的。相信通过多学科多领域的合作和努力,体外诱导生成血小板的的技术会日渐完善并最终获得成功。
本篇文章所含内容如果涉及侵权请联系我们及时处理,感谢您的理解!